- VALTRIA DANS NEWS -
Particularités des BPF dans la conception des installations de cannabis médical
1. Introduction
2. Cannabis médical
Le Cannabis est un cas particulier dans les pratiques habituelles de fabrication de médicaments pour les raisons suivantes :
- Bien qu’il existe de nombreux médicaments ou API et compléments d’origine végétale, ces derniers parviennent au consommateur final/patient sous forme d’extraits.
- Aucun autre, comme le cannabis, ne peut arriver autrement que dans des formats conventionnels sous la forme de fleur originale. (laissons de côté les formules magistrales à base de plantes, qui ont peu à peu disparu de la pharmacopée, et qui ne rentrent pas dans la définition des médicaments à effet thérapeutique)
- Le cannabis est un API (Principe Actif) très puissant, avec de multiples combinaisons de composants (cannabinoïdes, terpènes) et de multiples applications thérapeutiques, dont certaines avec des effets secondaires ou psychotropes (avec les implications de sécurité que cela implique).
- Les principales caractéristiques du cannabis en tant qu’API sont données par la génétique, mais au cours de la croissance de la plante, sa puissance (concentration) peut considérablement changer.
- Le cannabis a ouvert la porte à un nouveau profil professionnel en dehors du secteur de la production pharma, ce qui a conduit à des écarts dans l’application de la réglementation GMP dans ce processus.
3. Application des normes GMP
Examinons quelques particularités de l’application de ces normes GMP dans la production de Cannabis, sur la base de notre expérience et de notre analyse de risque du produit et du processus pour le cannabis.
Fleur de cannabis séchée “utilisation directe” comme médicament.
Selon le tableau 1 de l’application du guide GMP à la fabrication des substances actives d’origine végétale, nous serions situés au troisième rang :
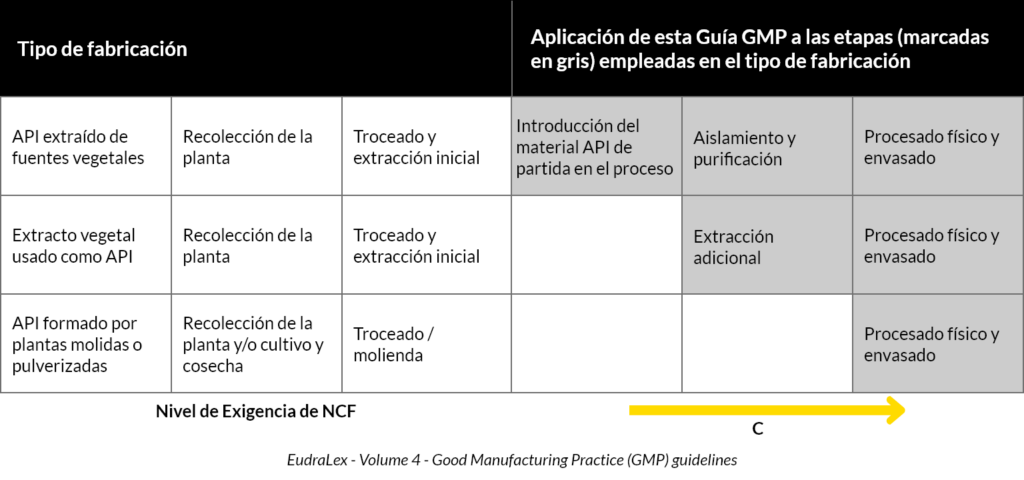
Suivant les indications du tableau, les normes GMP seront appliquées au moment du traitement physique et de l’emballage comprend le séchage et la coupe (dernières étapes de transformation avant la distribution aux patients).
Étant donné que les normes GMP ne s’appliquent qu’aux étapes finales du traitement, l’application des normes GACP (BPAR : Bonne pratique Agricole et Bonne Pratique de Récolte) pendant les phases de culture, revêt une importance toute particulière en raison des aspects suivants :
- Les différents principes actifs sont créés dans un environnement non contrôlé (selon le critère Farma) pendant plus de 10 semaines, nous sommes dans un cas atypique. Si nous faisons le parallèle avec la formulation d’une API, les GMP s’appliquent au moment où la molécule active apparaît. Ici non, la molécule active apparaît et se forme bien avant que nous entrions dans l’exigence GMP.
- Les conditions environnementales (Température, humidité et Lumière) ainsi que les procédés et stratégies de culture (densité, irrigation, engrais, …) influencent grandement la composition des différents API et le rendement de la récolte.
- N’importe lequel des paramètres précédents hors de contrôle peut invalider complètement le produit. Sachant que les GMP ne sont pas obligatoires, l’application des GACP revêt une importance accrue.
- L’évaluation des fournisseurs, la formation du personnel et l’état des installations exigent des procédures très rigoureuses, même si elles ne sont pas GMP.
Il est essentiel de contrôler les différents paramètres qui composent la phase de culture pour assurer la qualité, la stabilité et le rendement de la récolte.
De même, garder sous contrôle les paramètres précédents implique des coûts d’investissement et de fonctionnement plus importants, avec lesquels il est nécessaire de trouver un équilibre.
Fleur séchée de Cannabis "usage direct" en tant que médicament
Lorsqu’il s’agit de définir la classification de l’environnement contrôlé pour transformer le cannabis, nous revenons aux GMP et nous n’avons pas de réponse claire. Dans l’annexe 7, il nous est simplement indiqué de mettre en place des mesures particulières pour éviter la contamination croisée.
Du chapitre 1, de la nouvelle annexe 1, et ses “principes et lignes directrices, tels que la stratégie de contrôle de la contamination, la conception des installations, la classification des salles propres, la qualification, la validation, le suivi et l’habillement du personnel, peuvent être utilisés pour soutenir la fabrication d’autres produits qui ne sont pas destinés à être stériles, tels que certains liquides, crèmes, pommades et intermédiaires biologiques à faible charge microbienne, mais où le contrôle et la réduction de la contamination microbienne sont considérés comme importants”.
Nous avons opté pour passer à ISO 8, comme précaution minimale pour répondre aux caractéristiques de ce produit. Mais pourquoi pas une autre classification ?
Voyons quelques spécificités :
- Il s’agit d’une fabrication « mono-produit » mais dans laquelle, du fait de certains temps de traitement longs (séchage, affinage) différents lots peuvent coïncider dans l’espace de fabrication.
- Contrairement à d’autres produits pharmaceutiques, ici le risque de contamination croisée ne provient pas du mélange d’ingrédients actifs, même si des génétiques différentes sont traitées.
- Le plus grand risque est biologique (champignons, bactéries…), soit du produit lui-même, soit d’agents extérieurs. Cette contamination biologique peut être évidente et détectable dans les premières phases GMP et des contrôles qualité des lots, ou rester latente et se développer dans les premiers jours de la phase de séchage, où les conditions environnementales sont encore propices à la prolifération des champignons et des bactéries.
- Selon notre analyse, le plus grand risque de contamination croisée se produirait dans la salle de traitement humide et dans la salle de séchage. Pour ces salles, nous préconisons une conception sous pression de confinement et des procédures rigoureuses concernant les EPI et les actions correctives en cas de détection de contamination.
- Il est important de noter que pendant le processus, le produit est exposé pendant une longue période (voire des jours) à l’environnement de la salle qui fait office de conteneur. Pour cette raison, les procédures de nettoyage et de désinfection des salles doivent être exhaustives. Ici, nous allons revenir à l’annexe 1, avec l’obligation de développer un CCS, « Contamination Control Strategie », fin, et adapté à cette particularité, la plupart du temps, la salle, l’environnement, avec ses opérateurs, sont assimilés au conteneur, jusqu’à l’étape d’emballage.
Définition du lot
Dans les GMP, il est toujours fait référence au lot de fabrication, c’est-à-dire à une quantité fixe de produit obtenue dans les mêmes conditions et dans le même procédé pour assurer l’uniformité. Cela implique une grande complexité dans le cannabis médical. Une fois que l’application des GACP assure une uniformité maximale, dans la limite des possibilités des installations de culture disponibles, le processus GMP assure le maintien de cette uniformité :
- Les processus sont lents (un lot peut être entre un et 2 tours de travail en cours de traitement), et exposés à un environnement auquel le lot est sensible. Cet environnement doit être adéquat et contrôlé pour garantir que le premier et le dernier produit traité ont les mêmes caractéristiques.
- Dans le cas du séchage, il s’agit d’un volume important de produit qui est une matière “vivante”, qui évolue sur plusieurs jours. Les installations doivent être d’une conception optimale, dûment validée (cartographie des températures et de l’hygrométrie, recettes de séchage, procédures de remplissage, etc…)
- De nombreux processus nécessitent une intervention humaine. Pensons à différentes phases, par exemple, le coupage manuel ou le temps et les conditions d’affinage où les décisions sont subjectives.
- Enfin, la taille de chaque lot, après le long processus de plus de 100 jours depuis l’obtention des boutures jusqu’au produit final, peut fortement varier. Le rapprochement entre le nombre de plantes, les rejets, les résidus et le produit final obtenu est très complexe et critique car il s’agit d’un stupéfiant.
Fleur pour extraits de Cannabis médicinal
A ce stade, nous serions dans la première et la deuxième ligne du tableau 1 précédent (application du guide GMP).
D’après notre expérience, dans le cas d’un produit ne comportant qu’une seule extraction, celle-ci doit se faire dans un environnement GMP. En revanche, en cas d’extraction, plus une distillation ou une purification, l’extraction pourrait être réalisée en milieu NON GMP, à condition que les phases suivantes se déroulent nécessairement en environnement GMP.
Plus le produit à obtenir est purifié, plus la variabilité de la matière première (fleur) est grande, même si nous aurons un impact significatif sur les performances (coûts) de notre procédé. Cette variabilité dans les caractéristiques des fleurs permettrait une infrastructure de culture moins spécialisée mais ne dispense pas du strict respect des normes GACP, puisqu’une source végétale hors paramètres ne permet pas de respecter les normes de procédé GMP.
Pour les extractions full spectrum (première extraction) où la présence d’autres cannabinoïdes ou de terpènes est évaluée, on part de génétiques très spécifiques qui sont même associées à la description qui accompagne le produit final. La qualité de la fleur de départ est fondamentale (elle correspondrait à la fonction d’un réacteur pour les API chimiques). Pour cette qualité de “fleur GMP pour extraction” il est nécessaire que le responsable du médicament participe à la définition du processus d’obtention.
4. Conclusions
Nous voyons que faire la lumière sur la façon d’appliquer les normes GMP dans l’obtention de ce médicament particulier, passe par une connaissance détaillée du produit et du processus. Nous devons chercher une partie des réponses dans la nouvelle annexe 1, et nous forcer à développer un CCS, avec une base scientifique pour l’analyse des risques.
Cette approche des GMP au processus de production (certifiée par l’AEMPS) en plus d’assurer la qualité et la stabilité des produits, est l’étape fondamentale et obligatoire pour considérer le cannabis comme un médicament et le préservera des perceptions négatives de la part de la société.
5. Bibliographie
- Directives des Bonnes Pratiques de Fabrication des Médicaments : Directive 2003/94/CE, (Directive de la Commission (UE) 2017/1572 relative aux médicaments à usage humain – en particulier annexe 7, annexe 1
- ICHQ9 : Quality risk managment_2005
- ICHQ7A : GMP active pharmaceutical ingredients
- ICH Q10 : PHARMACEUTICAL QUALITY SYSTEM
- Pharmacopoea Helvetica 11.3 Ed-fr_2019 : Flor de cannabis, CH211-S-263
- Analytical Monograph Cannabis Flos – OMC / Farmalyse BV V7, Nov 28.2014
- Bundesinstitut für Arzneimittel und Medizinprodukte Bekanntmachung zum Deutschen Arzneibuch 2018* Vom 9. April 2018
- PIC/S GUIDE TO GOOD MANUFACTURING PRACTICE FOR MEDICINAL PRODUCTS
Eudald Bogatell
Ingénieur de projet chez VALTRIA
Lidia Campillo y Frederic Pascual
Collaborateurs