Les Bonnes Pratiques de Fabrication (BPF. GMP en anglais) ne sont pas des normes et des lignes directrices, comme peut l'être ISO, mais ce sont des Directives européennes (2003/94/CE), qui ont été transposées dans un système juridique espagnol, par le biais d'un décret royal 2183/2004.
En introduction et en conclusion, qui sont obligatoires.
Leur aspect "directives", laissent un certain niveau d’interprétation, qui diminue de jour en jour en raison du résultat des inspections, des détournements officiels, et étayé par les publications. Aux Etats-Unis, les cGMP (c=current) nous aident à réduire cette marge d’interprétation,
Selon la “loi”, nous sommes tenus de garantir la fabrication de produits “sûrs, de qualité et efficaces”.
Par conséquent, les différentes réglementations autour des GMP’s proposent des guides pour réduire cette marge d'interprétation. Cela nous permet de mettre en œuvre ces bonnes pratiques dans la conception et l'exploitation des installations. L'objectif reste le même : assurer un bon résultat de production du médicament sûr, efficace, fiable et stable dans le temps imparti.
Il convient de rappeler qu’une norme n’est pas obligatoire tant qu’un décret-loi n’a pas été dicté.
A noter alors que les BPF, mentionnent les ICH et l’ISO 14644.
Ces normes satellites ou obligatoires ont été élaborées pour définir plus précisément les processus et les activités “sensibles”.
Le grand nombre de procédés de fabrication de produits pharmaceutiques a conduit à la création de ces normes, si bien que, sauf cas inédits, les voies finissent par être assez claires.
Mais elles n’offrent pas non plus de réponses définitives et concrètes pour chaque cas, ce qui serait impossible avec l’infinité de produits, mais laissent sous la responsabilité finale du fabricant, la justification des solutions mises en œuvre, pour se conformer à cette BPF.
De là vient l'un des outils les plus commentés, avec le plus de publications, “l'analyse des risques” (généralement sur un processus) qui guide dans chaque cas sur les actions préventives (conception, procédures), organisationnelles et opérationnelles à mettre en œuvre.
Dans cet article, nous abordons certaines particularités de l’application des normes dans le cannabis médical, ainsi que la grande importance de l’application des normes GACP (bonnes pratiques agricoles et de récolte)
Le Cannabis est un cas particulier dans les pratiques habituelles de fabrication de médicaments pour les raisons suivantes :
Examinons quelques particularités de l’application de ces normes GMP dans la production de Cannabis, sur la base de notre expérience et de notre analyse de risque du produit et du processus pour le cannabis.
Selon le tableau 1 de l'application du guide GMP à la fabrication des substances actives d'origine végétale, nous serions situés au troisième rang:
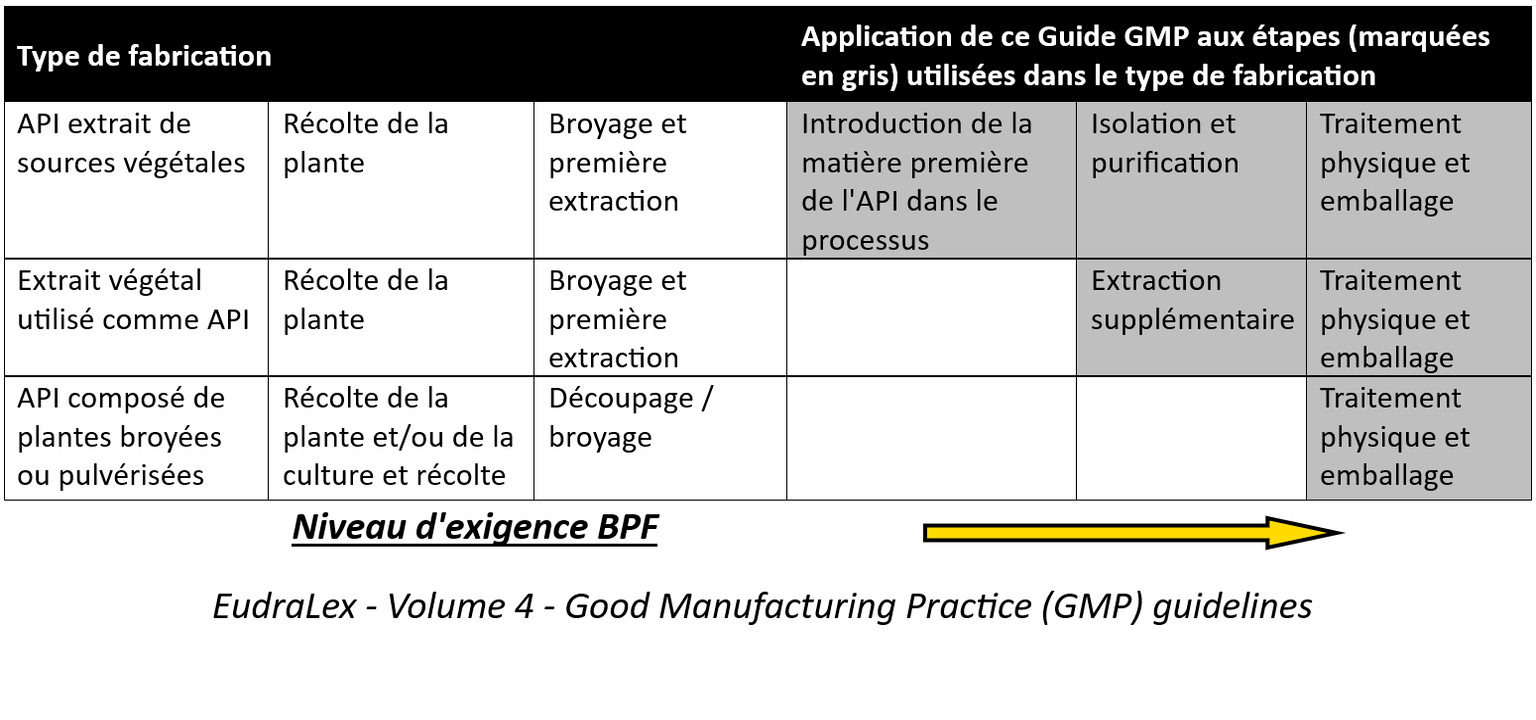
Suivant les indications du tableau, les normes GMP seront appliquées au moment du traitement physique et de l’emballage comprend le séchage et la coupe (dernières étapes de transformation avant la distribution aux patients).
Étant donné que les normes GMP ne s’appliquent qu’aux étapes finales du traitement, l’application des normes GACP (BPAR: Bonne pratique Agricole et Bonne Pratique de Récolte) pendant les phases de culture, revêt une importance toute particulière en raison des aspects suivants :
Il est essentiel de contrôler les différents paramètres qui composent la phase de culture pour assurer la qualité, la stabilité et le rendement de la récolte.
De même, garder sous contrôle les paramètres précédents implique des coûts d'investissement et de fonctionnement plus importants, avec lesquels il est nécessaire de trouver un équilibre.
Lorsqu'il s'agit de définir la classification de l'environnement contrôlé pour transformer le cannabis, nous revenons aux GMP et nous n'avons pas de réponse claire. Dans l’annexe 7, il nous est simplement indiqué de mettre en place des mesures particulières pour éviter la contamination croisée.
Du chapitre 1, de la nouvelle annexe 1, et ses “principes et lignes directrices, tels que la stratégie de contrôle de la contamination, la conception des installations, la classification des salles propres, la qualification, la validation, le suivi et l'habillement du personnel, peuvent être utilisés pour soutenir la fabrication d'autres produits qui ne sont pas destinés à être stériles, tels que certains liquides, crèmes, pommades et intermédiaires biologiques à faible charge microbienne, mais où le contrôle et la réduction de la contamination microbienne sont considérés comme importants”.
Nous avons opté pour passer à ISO 8, comme précaution minimale pour répondre aux caractéristiques de ce produit. Mais pourquoi pas une autre classification ?
Voyons quelques spécificités :
Dans les GMP, il est toujours fait référence au lot de fabrication, c’est-à-dire à une quantité fixe de produit obtenue dans les mêmes conditions et dans le même procédé pour assurer l’uniformité. Cela implique une grande complexité dans le cannabis médical. Une fois que l'application des GACP assure une uniformité maximale, dans la limite des possibilités des installations de culture disponibles, le processus GMP assure le maintien de cette uniformité :
A ce stade, nous serions dans la première et la deuxième ligne du tableau 1 précédent (application du guide GMP).
D’après notre expérience, dans le cas d’un produit ne comportant qu’une seule extraction, celle-ci doit se faire dans un environnement GMP. En revanche, en cas d’extraction, plus une distillation ou une purification, l’extraction pourrait être réalisée en milieu NON GMP, à condition que les phases suivantes se déroulent nécessairement en environnement GMP.
Plus le produit à obtenir est purifié, plus la variabilité de la matière première (fleur) est grande, même si nous aurons un impact significatif sur les performances (coûts) de notre procédé. Cette variabilité dans les caractéristiques des fleurs permettrait une infrastructure de culture moins spécialisée mais ne dispense pas du strict respect des normes GACP, puisqu'une source végétale hors paramètres ne permet pas de respecter les normes de procédé GMP.
Pour les extractions full spectrum (première extraction) où la présence d’autres cannabinoïdes ou de terpènes est évaluée, on part de génétiques très spécifiques qui sont même associées à la description qui accompagne le produit final. La qualité de la fleur de départ est fondamentale (elle correspondrait à la fonction d'un réacteur pour les API chimiques). Pour cette qualité de “fleur GMP pour extraction” il est nécessaire que le responsable du médicament participe à la définition du processus d'obtention.
Nous voyons que faire la lumière sur la façon d’appliquer les normes GMP dans l’obtention de ce médicament particulier, passe par une connaissance détaillée du produit et du processus. Nous devons chercher une partie des réponses dans la nouvelle annexe 1, et nous forcer à développer un CCS, avec une base scientifique pour l'analyse des risques.
Cette approche des GMP au processus de production (certifiée par l'AEMPS) en plus d'assurer la qualité et la stabilité des produits, est l'étape fondamentale et obligatoire pour considérer le cannabis comme un médicament et le préservera des perceptions négatives de la part de la société.
Auteur:
Eudald Bogatell
Collaborateurs:
Lidia Campillo
Frederic Pascuar