- Valtria en Noticias -
Particularidades de las GMP en el diseño de las instalaciones de Cannabis Medicinal
1. Introducción
Las Buenas Prácticas de Fabricación (BPF. GMP en inglés) no son normas y directrices, como lo pueden ser las ISO, pero son Directivas europeas, (2003/94/CE), que se transpusieron a un ordenamiento jurídico español, a través de un real decreto 2183/2004.
En introducción y conclusión, que son de cumplimiento obligatorias.
Su aspecto “directivas”, dejan un cierto nivel de interpretación, que se va reduciendo día a día por el resultado de las inspecciones, desviaciones oficiales, y soportado por la literatura. En EEUU, nos ayudan las cGMP (c=current) permitiendo reducir este margen de interpretación.
Por “ley” estamos obligados a garantizar la fabricación de productos “seguros, de calidad y eficientes”.
Las diferentes normativas alrededor de las GMP’s ofrecen unas guías para reducir este margen de interpretación. Esto nos permite implementar estas correctas prácticas en el diseño y en la explotación de las instalaciones. El objetivo sigue siendo el mismo: asegurar un buen resultado de producción del medicamento seguro, eficiente, fiable y estable en el tiempo establecido.
Hay que recordar que una norma no es de obligado cumplimiento, hasta que lo dicte un decreto de ley.
A destacar entonces que las BPF, mencionan las ICH y la ISO 14644.
Estas normas satélites u obligatorias se han desarrollado para definir con mayor precisión los procesos y actividades “sensibles”.
La gran cantidad de procesos de fabricación de productos farmacéuticos provoca que se hayan creado estos estándares, con lo que, excepto casos novedosos, los caminos acaban por ser bastante claros.
Pero tampoco ofrecen unas respuestas definitivas y concretas para cada caso, que sería imposible con la infinidad de productos, sino que dejan bajo la responsabilidad final del fabricante, la justificación de las soluciones implementadas, para cumplir dicha BPF.
De aquí, llega, una de las herramientas más comentadas, con más literatura, “el análisis de riesgos” (generalmente sobre un proceso) que orientan en cada caso sobre las acciones preventivas (diseño, procedimientos), organizacionales y operacionales a implementar.
En este articulo abordamos algunas particularidades de la aplicación de la normativa del cannabis medicinal, así como la gran importancia de la implementación de las normas GACP (buenas prácticas de agricultura y recolección).
2. Cannabis medicinal
El Cannabis es un caso particular dentro de las prácticas habituales de fabricación de medicamentos por los siguientes motivos:
- Si bien existen muchos medicamentos o API’s y suplementos de origen vegetal, éstos llegan al consumidor final/paciente en forma de extractos.
- Ningún otro, como el cannabis, puede llegar además de en los formatos convencionales en forma primigenia de flor (dejamos de lado, las fórmulas magistrales a base de plantas, que desaparecieron poco a poco de la pharmacopea, y que no entran en la definición de medicamentos con efecto terapéutico).
- El cannabis se trata de un API muy potente, con múltiples combinaciones de componentes (cannabinoides, terpenos) y múltiples aplicaciones terapéuticas, algunas de ellas con efectos secundarios o psicotrópicos (con las implicaciones de seguridad que conlleva).
- Las principales características del cannabis como API vienen dadas por una genética, pero durante el crecimiento de la planta, puede cambiar en gran manera su potencia (concentración).
- El cannabis ha abierto la puerta a un nuevo perfil profesional ajeno al sector productivo farma lo que ha conllevado discrepancias en la aplicación de la normativa GMP en este proceso.
3. Aplicación normativa GMP
Analicemos algunas particularidades de la aplicación de estas normas GMP en la producción de Cannabis, en base a nuestra experiencia y nuestros análisis de riesgo del producto y del proceso para el cannabis.
Flor seca de Cannabis “uso directo” como medicamento.
Según la tabla 1 de aplicación de la guía GMP a la fabricación de sustancias activas de origen vegetal, estaríamos ubicados en la tercera fila:
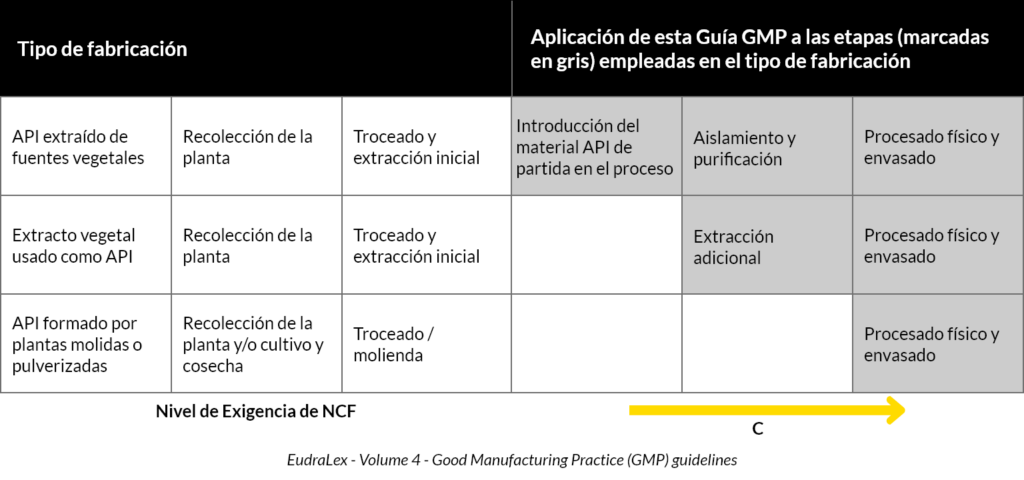
Siguiendo las indicaciones de la tabla, las normas GMP se empezarán a aplicar en el momento del procesado físico y envasado incluye el secado y afeitado (últimas etapas de transformación antes de su dispensación a pacientes).
Debido a que las normas GMP aplican sólo en los pasos finales del procesado, cobra especial importancia la aplicación de las normas GACP durante las fases del cultivo, debido a los siguientes aspectos:
- Los diferentes principios activos se crean en un ambiente no controlado (según el criterio Farma) durante más de 10 semanas, estamos en un caso atípico. Si hacemos el paralelo con la formulación de un API, las GMP se aplican al momento en el cual aparece la molécula activa. Aquí no, la molécula activa aparece y se forma mucho antes de que entremos en la exigencia GMP.
- Las condiciones ambientales (Temperatura, humedad y Luz) así como los procesos y estrategias de cultivo (densidad, riego, fertilizantes, …) influyen en gran manera en la composición de los diferentes API y el rendimiento de la cosecha.
- Alguno de los parámetros anteriores fuera de control puede invalidar el producto completamente. Sabiendo que no son de obligado cumplimiento las GMP, cobra mayor importancia la aplicación de las GACP.
- Evaluación de proveedores, formación de personal, estado de las instalaciones requieren de procedimientos muy rigurosos, aunque no se trate de GMP.
Es indispensable controlar los diferentes parámetros que conforman la fase de cultivo para asegurar la calidad, estabilidad y el rendimiento del cultivo.
Así mismo, mantener los anteriores parámetros bajo control supone una mayor inversión y costes de explotación con lo que es necesario encontrar el equilibrio.
Flor seca de Cannabis “uso directo” como medicamento
A la hora de definir la clasificación del ambiente controlado para procesar el cannabis, volvemos a las GMP y nos quedamos sin respuesta clara. En el anexo 7, nos dice simplemente de implementar medidas particulares, para evitar contaminación cruzada.
Del capítulo 1, del nuevo anexo 1, y sus “principios y orientaciones, como la estrategia de control de la contaminación, el diseño de las instalaciones, la clasificación de salas limpias, la cualificación, la validación, el monitoreo y el vestuario del personal, se pueden utilizar para respaldar la fabricación de otros productos que no tienen la intención de ser estériles, como ciertos líquidos, cremas, ungüentos e intermediarios biológicos de baja carga microbiana, pero donde se considera importante el control y la reducción de la contaminación microbiana”.
Nos quedamos con la elección de ir a ISO 8, como mínima precaución para responder las características de este producto. Pero ¿por qué no otra clasificación?
Veamos algunas particularidades:
- Se trata de una fabricación “monoproducto” pero en la que, debido a algunos tiempos largos de proceso (secado, curado) diferentes lotes pueden coincidir en el espacio de fabricación.
- A diferencia de otros productos farma, aquí el riesgo de contaminación cruzada no proviene de mezclas de principios activos, incluso si se procesan diferentes genéticas.
- El mayor riesgo es el biológico (hongos, bacterias…), ya sea del mismo producto o de agentes externos. Esta contaminación biológica puede ser evidente y detectable en las primeras fases GMP y controles de calidad del lote, o permanecer latente y desarrollarse en los primeros días de la fase de secado, donde se tienen unas condiciones ambientales todavía aptas para la proliferación de hongos y bacterias.
- Según nuestro análisis el mayor riesgo de contaminación cruzada se daría en la sala de procesado húmedo y en la de secado. Para estas salas aconsejamos un diseño de presiones en contención y unos procedimientos rigurosos respecto a los EPI´s y actuaciones correctivas en caso de detección de contaminaciones.
- Es importante reseñar que durante el proceso el producto está mucho tiempo (incluso días) expuesto al ambiente de la sala que actúa como contenedor. Por ello los procedimientos de limpieza y desinfección de las salas deben ser exhaustivos. Aquí vamos a volver al anexo 1, con la obligación de desarrollar un CCS, “Contamination Control Strategie”, fino, y adaptado a esta peculiaridad, de que la mayor parte el tiempo, la sala, el ambiente, con sus operarios, se asimila al contenedor, hasta la etapa de empaquetado.
Definición de lote
En las GMP se hace siempre referencia al Lote de fabricación es decir una cantidad fija de producto obtenida bajo las mismas condiciones y proceso para garantizar la uniformidad. Esto implica una gran complejidad en el cannabis medicinal. Una vez la aplicación de las GACP aseguran el máximo de uniformidad, dentro de las posibilidades de las instalaciones de cultivo que se disponen, el proceso GMP se asegura de mantener esta uniformidad:
- Los procesos son lentos (un lote puede estar entre uno y 2 turnos de trabajo procesándose), y expuestos a un ambiente al cual es sensible. Este ambiente tiene que ser el adecuado y controlado para asegurar que el primer y el último producto procesado tiene las mismas características.
- En el caso del secado, se tiene un gran volumen de producto que es un material “vivo”, que evoluciona durante varios días. Las instalaciones tienen que ser de un diseño óptimo, debidamente validadas (mapeo de temperaturas y humedades, recetas de secado, procedimientos de llenado, etc…)
- Muchos procesos requieren intervención humana. Pensemos en diferentes fases por ejemplo el afeitado manual o el tiempo y condiciones de curado en donde las decisiones son subjetivas.
- Finalmente, el tamaño de cada lote, después del largo proceso de más de 100 días desde la obtención de esquejes hasta el producto final puede variar mucho. La conciliación entre el número de plantas, los descartes, los residuos y el producto final obtenido es muy compleja y critica al tratarse de un estupefaciente.
Flor para extractos de Cannabis medicinal
En este punto, estaríamos en la primera y segunda fila de la anterior tabla 1 (aplicación de la guía GMP).
Según nuestra experiencia en el caso de un producto en el que solo se realice una extracción, ésta debe hacerse en un entorno GMP. En cambio, si se da una extracción, más una destilación o purificación se podría realizar la extracción en entorno NO GMP, siempre y cuando las siguientes fases se den necesariamente en entorno GMP.
Cuanto más purificado sea el producto a obtener, mayor variabilidad puede tener el material de partida (flor), aunque tendremos un impacto importante en el rendimiento (costes) de nuestro proceso. Esta variabilidad en las características de las flores permitiría tener una infraestructura de cultivo menos especializada pero no exime del estricto cumplimiento de las normas GACP, ya que una fuente vegetal fuera de parámetros no permite cumplir con los estándares del proceso GMP.
Para extracciones full espectrum (primera extracción) en donde se valore la presencia de otros cannabinoides o de terpenos, se parte de genéticas muy concretas que incluso se asocian a la descripción que acompaña al producto final. La calidad de la flor de partida es fundamental (correspondería a la función de un reactor para API’s químicos). Para esta calidad de “flor GMP para extracción” se hace necesario que el responsable del fármaco participe en la definición del proceso de obtención.
4. Conclusiones
Vemos que arrojar luz sobre cómo aplicar la normativa del cannabis medicinal GMP en la obtención de este particular medicamento, pasa por un conocimiento detallado del producto y del proceso. Tenemos que ir a buscar parte de las respuestas en el nuevo anexo 1, y obligarnos a desarrollar un CCS, con una base científica de análisis de riesgo.
Este enfoque de las GMP al proceso productivo de cannabis medicinal (certificado por la AEMPS) además de asegurar la calidad y estabilidad de los productos, es el paso básico y obligatorio, para considerar el cannabis como medicamento y lo alejará de percepciones negativas por parte de la sociedad.
5. Bibliografia
- Normas de Correcta Fabricación de Medicamentos: la Directiva 2003/94/CE, (Commission Directive (EU) 2017/1572 for medicinal products for human use- en particular annexo 7, annexo1
- ICHQ9: Quality risk managment_2005
- ICHQ7A: GMP active pharmaceutical ingredients
- ICH Q10 : PHARMACEUTICAL QUALITY SYSTEM
- Pharmacopoea Helvetica 11.3 Ed-fr_2019 : Flor de cannabis, CH211-S-263
- Analytical Monograph Cannabis Flos – OMC / Farmalyse BV V7, Nov 28.2014
- Bundesinstitut für Arzneimittel und Medizinprodukte Bekanntmachung zum Deutschen Arzneibuch 2018* Vom 9. April 2018
- PIC/S GUIDE TO GOOD MANUFACTURING PRACTICE FOR MEDICINAL PRODUCTS
Eudald Bogatell
Ingeniero de proyectos en VALTRIA
Lidia Campillo y Frederic Pascual
Colaboradores