Gute Herstellungspraktiken (GHP, GMP - Good Manufacturing Practice im Englischen) sind keine Normen und Richtlinien, wie es die ISO sein kann, sondern sie sind europäische Richtlinien (2003/94/EG), die durch das Königliche Dekret 2183/2004 in spanisches Recht umgesetzt worden.
In der Einführung und in der Schlussfolgerung sind sie verpflichtend einzuhalten.
Ihr „Richtlinien"-Aspekt lässt einen gewissen Interpretationsspielraum zu, der Tag für Tag durch das Ergebnis von Inspektionen, behördlichen Anpassungen und durch die Literatur gestützt wird. In den USA hilft uns die cGMP (c=current), diesen Interpretationsspielraum zu verringern.
Per „Gesetz" sind wir verpflichtet, die Herstellung von „sicheren, qualitativ hochwertigen und effizienten" Produkten zu gewährleisten.
Die verschiedenen Vorschriften rund um die GMP bieten also Leitlinien, um diesen Interpretationsspielraum zu verringern. Dies ermöglicht es uns, diese richtigen Praktiken bei der Gestaltung und dem Betrieb der Anlagen umzusetzen. Das Ziel bleibt dasselbe: ein sicheres, effizientes, zuverlässiges und stabiles Ergebnis bei der Herstellung von Arzneimitteln innerhalb des festgelegten Zeitrahmens zu gewährleisten.
Es sei daran erinnert, dass eine Norm erst dann verbindlich ist, wenn sie durch eine Rechtsverordnung vorgeschrieben wird.
Es sei noch darauf hingewiesen, dass in der GMP die ICH und ISO 14644 erwähnt werden.
Diese freiwilligen oder Pflichtnormen wurden entwickelt, um, sensible" Prozesse und Tätigkeiten genauer zu definieren.
Die große Zahl der pharmazeutischen Herstellungsverfahren hat zur Schaffung dieser Normen geführt, so dass die Wege, abgesehen von neuartigen Fällen, letztendlich recht klar sind.
Sie bieten jedoch keine endgültigen und konkreten Antworten für jeden einzelnen Fall, was bei der unendlichen Anzahl von Produkten unmöglich wäre, sondern überlassen es letztlich dem Hersteller, die zur Einhaltung der GMP umgesetzten Lösungen zu begründen.
Dies führt zu einem der meistdiskutierten und meistgelesenen Instrumente, der „Risikoanalyse" (im Allgemeinen für einen Prozess), die in jedem Fall Hinweise auf die zu ergreifenden präventiven (Konzeption, Verfahren), organisatorischen und operativen Maßnahmen gibt.
In diesem Artikel befassen wir uns mit einigen Besonderheiten der Anwendung von Standards bei medizinischem Cannabis sowie mit der großen Bedeutung der Umsetzung der GACP-Normen (Gute Praxis für die Sammlung und Anbau von Arzneipflanzen).
Cannabis ist aus den folgenden Gründen ein Sonderfall innerhalb der medizinischen Standardherstellungspraxis:
Lassen Sie uns einige Besonderheiten der Anwendung dieser GMP-Vorschriften bei der Erzeugung von Cannabis analysieren, basierend auf unserer Erfahrung und unserer Risikoanalyse des Produkts und des Prozesses für Cannabis.
Nach Tabelle 1 der Anwendung des GMP-Leitfadens auf die Herstellung von aktiven Wirkstoffen pflanzlichen Ursprungs wäre unser Bezugspunkt die dritte Reihe:
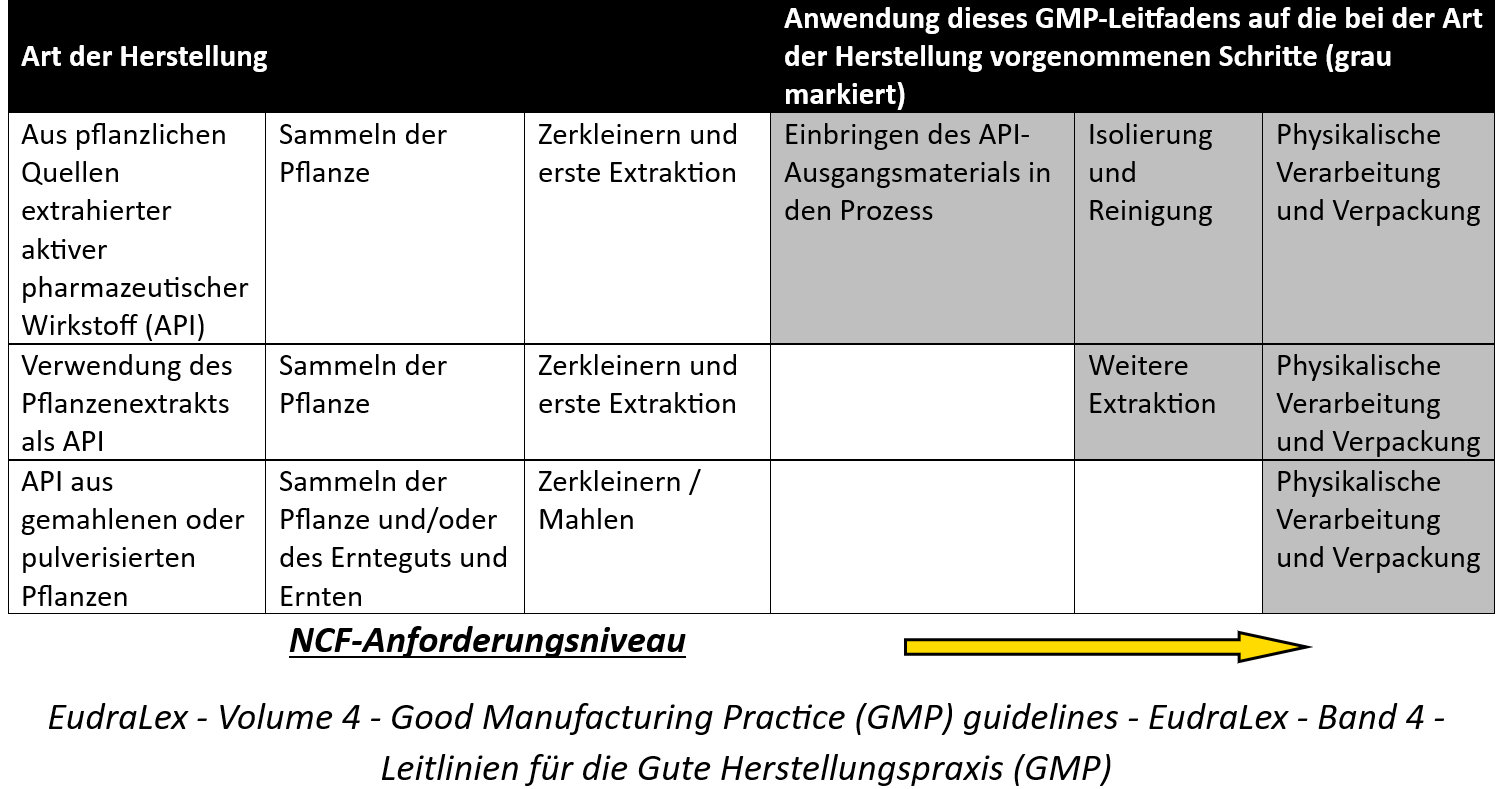
Gemäß den Angaben in der Tabelle gelten die GMP-Standards ab dem Zeitpunkt der physischen Verarbeitung und Verpackung einschließlich Trocknung und Schabung (letzte Verarbeitungsschritte vor der Abgabe an den Patienten).
Da die GMP-Standards nur für die letzten Verarbeitungsschritte gelten, ist die Anwendung der GACP-Standards während der Anbauphasen aufgrund der folgenden Aspekte von besonderer Bedeutung:
Es ist wichtig, die verschiedenen Parameter der Anbauphase zu kontrollieren, um die Qualität, die Stabilität und den Ertrag der Pflanzen zu gewährleisten.
Gleichzeitig ist die Kontrolle der genannten Parameter mit höheren Investitions- und Betriebskosten verbunden, so dass ein ausgewogenes Verhältnis gefunden werden muss.
Wenn es darum geht, die Klassifizierung der kontrollierten Umgebung für die Verarbeitung von Cannabis zu definieren, kommen wir auf die GMP zurück und haben keine eindeutige Antwort parat. In Anhang 7 heißt es lediglich, dass bestimmte Maßnahmen zur Vermeidung von Kreuzkontaminationen getroffen werden müssen.
In Kapitel 1 des neuen Anhangs 1 heißt es: „Grundsätze und Leitlinien, wie z. B. Kontaminationskontrollstrategie, Anlagenkonzeption, Reinraumklassifizierung, Qualifizierung, Validierung, Überwachung und Personalkleidung, können zur Unterstützung der Herstellung anderer Produkte verwendet werden, die nicht steril sein sollen, wie z. B. bestimmte Flüssigkeiten, Cremes, Salben und biologische Zwischenprodukte mit geringer mikrobieller Belastung, bei denen jedoch die Kontrolle und Verringerung der mikrobiellen Kontamination als wichtig erachtet wird".
Es bleibt also nur die Entscheidung für ISO 8 als Mindestmaß an Vorsichtsmaßnahmen, um den Eigenschaften dieses Produkts gerecht zu werden. Aber warum nicht eine andere Klassifizierung?
Schauen wir uns einige Besonderheiten an:
In der GMP wird stets auf die Herstellungscharge Bezug genommen, d. h. auf eine feste Menge eines Produkts, das unter denselben Bedingungen und nach demselben Verfahren hergestellt wurde, um die Einheitlichkeit zu gewährleisten. Dies bedeutet bei medizinischem Cannabis eine große Komplexität. Sobald die Anwendung der GACP ein Höchstmaß an Einheitlichkeit im Rahmen der Möglichkeiten der Anbaumöglichkeiten gewährleistet, stellt der GMP-Prozess sicher, diese Einheitlichkeit zu beizubehalten:
An diesem Punkt würden wir uns in der ersten und zweiten Zeile der obigen Tabelle 1 befinden (Anwendung der GMP-Leitlinien).
Nach unserer Erfahrung muss bei einem Produkt, bei dem nur eine Extraktion durchgeführt wird, diese in einer GMP-Umgebung erfolgen. Wird dagegen eine Extraktion mit anschließender Destillation oder Reinigung durchgeführt, kann die Extraktion in einer NON-GMP-Umgebung erfolgen, solange die folgenden Schritte unbedingt in einer GMP-Umgebung durchgeführt werden.
Je reiner das zu gewinnende Produkt ist, desto größer kann die Variabilität des Ausgangsmaterials (der Blüte) sein, was sich allerdings erheblich auf die Leistung (Kosten) unseres Prozesses auswirkt. Diese Variabilität in den Eigenschaften der Blüten würde es uns ermöglichen, eine weniger spezialisierte Anbauinfrastruktur zu haben, entbindet uns aber nicht von der strengen Einhaltung der GACP-Standards, da eine pflanzliche Quelle abseits der Parameter uns nicht erlaubt, die Standards des GMP-Prozesses einzuhalten.
Für Vollspektrum-Extraktionen (erste Extraktion), bei denen das Vorhandensein anderer Cannabinoide oder Terpene bewertet wird, ist der Ausgangspunkt eine sehr spezifische Genetik, die sogar mit der Beschreibung des Endprodukts verbunden ist. Die Qualität der Ausgangsblüte ist von grundlegender Bedeutung (sie würde der Funktion eines Reaktors für chemische APIs entsprechen). Für diese Qualität der „GMP-Blume für die Extraktion" ist es notwendig, dass die für das Medikament verantwortliche Person an der Definition des Erzeugungsprozesses beteiligt ist.
Es ist erkennbar, dass die Anwendung der GMP-Normen bei der Herstellung dieses speziellen Arzneimittels eine detaillierte Kenntnis des Produkts und des Prozesses erfordert. Wir müssen einen Teil der Antworten im neuen Anhang 1 suchen und uns zwingen, ein SCC (Safety Certificate for Contractors) mit einer wissenschaftlichen Grundlage für die Risikoanalyse zu entwickeln.
Dieser GMP-Ansatz für den Produktionsprozess (zertifiziert durch die AEMPS - Spanische Agentur für Arzneimittel und Medizinprodukte) ist neben der Gewährleistung der Qualität und Stabilität der Produkte der grundlegende und obligatorische Schritt, um Cannabis als Medikament zu betrachten und es von der negativen Wahrnehmung durch Teile der Gesellschaft fernzuhalten.
Autor:
Eudald Bogatell
Mitarbeitende:
Lidia Campillo
Frederic Pascuar