As Boas Práticas de Fabrico (BPF, ou, GMP, na sigla em inglês) não são normas e diretrizes, como acontece com as ISO, mas, sim, Diretivas europeias (2003/94/CE), que foram transpostas para o ordenamento jurídico espanhol através do Real Decreto 2183/2004.
A introdução e a conclusão são de cumprimento obrigatório.
Por serem "diretivas", permitem um certo nível de interpretação, que se vai estreitando, de dia para dia, em resultado das inspeções, de não conformidades formais e com base na literatura. Nos Estados Unidos, o recurso às cGMP/BMF (c=vigente) veio reduzir essa margem de interpretação.
Por força da lei, somos obrigados a garantir o fabrico de produtos "seguros, de qualidade e eficientes".
Para esse efeito, as diferentes normativas associadas às BPF oferecem orientações para reduzir essa margem de interpretação. Tal vai permitir implementar estas boas práticas no desenho e exploração das instalações. O objetivo mantém-se o mesmo: assegurar um bom resultado de produção do medicamento seguro, eficiente, fiável, no tempo estabelecido.
Ter em atenção que uma norma só passa a ser de cumprimento obrigatório quando for promulgada por decreto-lei.
Muito importante também: as BPF remetem para as normas ICH e ISO 14644.
Estas normas satélite ou obrigatórias foram desenvolvidas para definir com maior precisão os processos e atividades "sensíveis".
A grande quantidade de processos de fabrico de produtos farmacêuticos motivou a criação dessas normas harmonizadas, que permitem clarificar bastante os processos, exceto tratando-se de casos mais inovadores.
O que não quer dizer que ofereçam respostas definitivas e concretas para cada caso, pois tal seria impossível dado o grande número de produtos. Assim, a fim de cumprir a respetiva BPF, essas normas ficam sujeitas à responsabilidade final de fabricante e à fundamentação das soluções implementadas.
É neste contexto que nos chega uma das ferramentas mais debatidas e com mais literatura de apoio: a "análise de riscos" (geralmente sobre um processo) que, conforme o caso, servem de orientação às ações preventivas (desenho, procedimentos), organizacionais e operacionais a implementar.
Neste artigo, abordamos algumas particularidades da aplicação das normas para o caso da canábis medicinal e a grande importância da implementação das normas GACP (Boas práticas agrícolas e de colheita)
A canábis representa um caso particular dentro das práticas comuns de fabrico de medicamentos, pelos seguintes motivos:
Vejamos agora algumas particularidades da aplicação dessas normas BPF na produção de canábis, derivadas da na nossa experiência e análise de risco do produto e de processo relativamente à canábis.
De acordo com a tabela 1 sobre a aplicação do guia de BPF ao fabrico de substâncias ativas de origem vegetal, estaríamos situados na terceira linha:
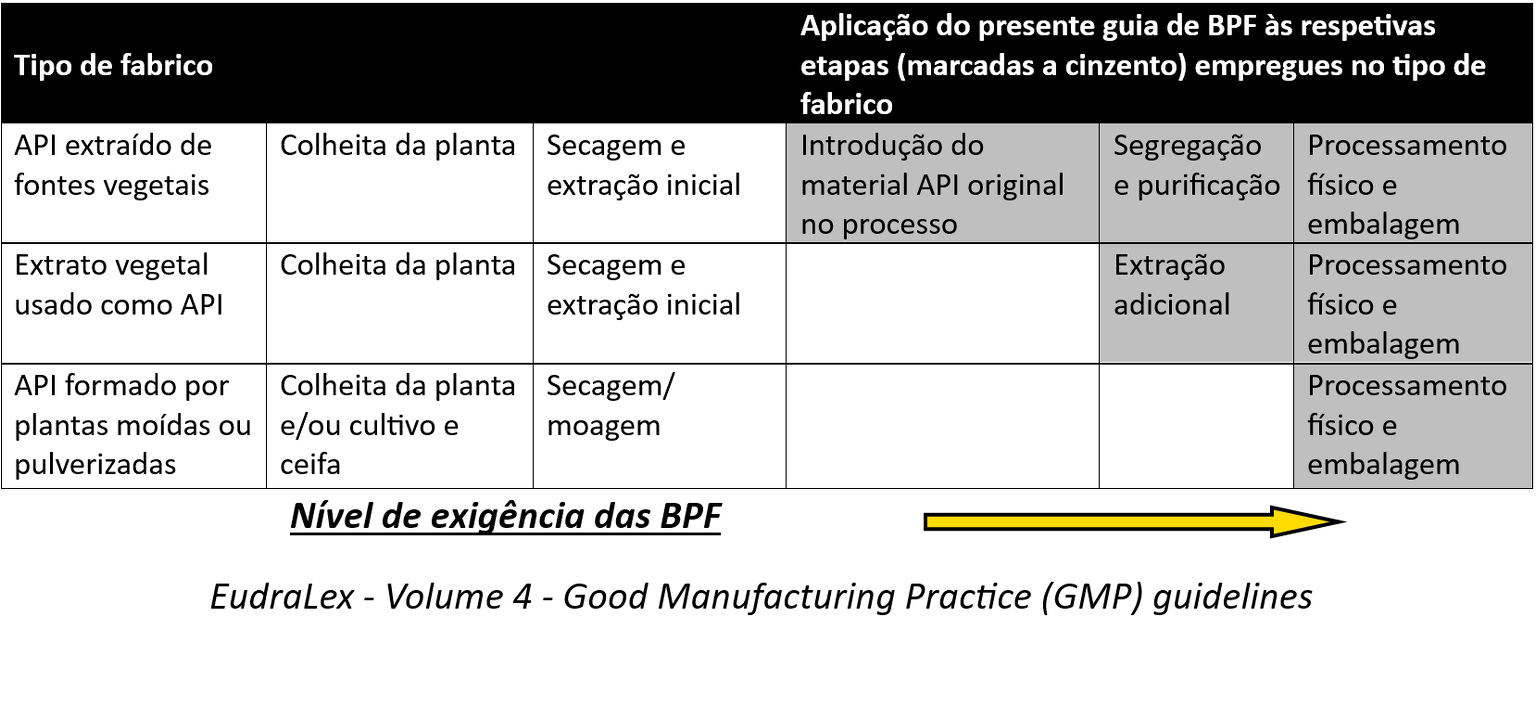
De acordo com as indicações da tabela, as normas BPF começaram a ser aplicadas no momento do processamento físico e da embalagem, incluindo a secagem e corte (últimas etapas da transformação, antes da dispensa aos pacientes).
Tendo em conta que as normas BPF se aplicam apenas nas fases finais do processamento, deverá ser dada particular importância à aplicação das normas GACP durante as fases de cultivo, devido aos aspetos seguintes:
É indispensável controlar os diferentes parâmetros envolvidos na fase de cultivo, para garantir a qualidade, estabilidade e o rendimento do cultivo.
Por outro lado, manter os parâmetros acima referidos sob controlo implica custos de investimento e de exploração superiores, pelo que é necessário encontrar um equilíbrio.
No momento de definir a classificação do ambiente controlado para processamento da canábis, voltamos às BPF e continuamos sem uma resposta clara. No anexo 7, é-nos dito simplesmente para implementar medidas particulares, de forma a evitar a contaminação cruzada.
A partir do Capítulo 1, do novo Anexo 1 e dos seus "princípios e orientações, tais como a estratégia de controlo da contaminação, o desenho das instalações, a classificação das salas limpas, a qualificação, a validação, a monitorização e o vestuário do pessoal, podem ser utilizados para apoiar o fabrico de outros produtos que não se destinam a ser estéreis, como, por ex., certos líquidos, cremes, pomadas e produtos intermédios biológicos com baixa carga microbiana, mas em que o controlo e a redução da contaminação microbiana são considerados importantes".
Resta-nos a opção de passar à norma ISO 8, como precaução mínima para responder às características deste produto. E por que não outra classificação?
Vejamos algumas particularidades:
Nas BPF, é sempre feita referência ao "Lote de fabrico", ou seja, a uma quantidade fixa de produto que é obtida respeitando as mesmas condições e processo, a fim de garantir a uniformidade. Quando falamos de canábis medicinal, este aspeto está envolto por uma grande complexidade. Uma vez que a aplicação da GACP garante a máxima uniformidade, dentro das possibilidades das instalações de cultivo disponíveis, o processo BPF garante que esta uniformidade seja respeitada:
Neste ponto, estaríamos nas primeira e segunda linhas da tabela 1 acima (aplicação da guia de BPF).
De acordo com a nossa experiência, no caso de um produto em que se realiza apenas uma extração, esta deve ser feita em ambiente BPF. Por outro lado, se houver uma extração e uma destilação ou purificação, a extração pode ser realizada em ambiente NÃO BPF, desde que as etapas seguintes sejam necessariamente realizadas em ambiente BPF.
Quanto mais purificado for o produto a obter, maior variabilidade pode ter o material original (flor), embora isso tenha um impacto importante no rendimento (custos) do nosso processo. Esta variabilidade nas características das flores permitiria uma infraestrutura de cultivo menos especializada, mas não dispensa o cumprimento rigoroso das normas GACP, uma vez que uma origem vegetal fora dos parâmetros não permite o cumprimento das normas de processo BPF.
Para extrações de espetro total (primeira extração) em que se avalia a presença de outros canabinoides ou terpenos, parte-se de genéticas muito específicas que chegam a ser incluídas na descrição que acompanha o produto final. A qualidade da flor original é fundamental (corresponderia à função de um reator no caso de um API químico). Para esta qualidade de "flor BPF para extração", é necessário que o responsável pelo medicamento esteja envolvido na definição do processo de produção.
Podemos ver que, para esclarecer como aplicar as normas BPF na produção deste medicamento em particular, é necessário um conhecimento pormenorizado do produto e do processo. Temos de procurar parte das respostas no novo Anexo 1 e obrigar-nos a desenvolver um CCS, com uma base científica de análise de risco.
Esta abordagem dos processos de produção (certificado pela AEMPS) pelas BPF, para além de garantir a qualidade e a estabilidade dos produtos, é o passo básico e obrigatório para considerar a canábis como um medicamento e afastá-la de perceções negativas por parte da sociedade.
Autor:
Eudald Bogatell
Colaboradores:
Lidia Campillo
Frederic Pascuar